Técnica simple para obtener ADN genómico adecuado para análisis de genotipado en ovinos a partir de hisopados nasales
DOI:
https://doi.org/10.31285/AGRO.28.1452Palabras clave:
chip de SNP, extracción de ADN, hisopado nasal, ovinos, análisis de concordanciaResumen
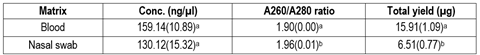
El aislamiento de ADN genómico de alta calidad y cantidad es fundamental para los estudios moleculares. Es crucial seleccionar una técnica sencilla y no invasiva para garantizar la recolección eficiente de ADN, particularmente a nivel de los establecimientos. El objetivo de este estudio fue determinar si los hisopados nasales son una matriz biológica apropiada para obtener ADN genómico de buena calidad para el genotipado de SNP. En el estudio se evaluaron y compararon dos matrices biológicas (sangre e hisopados nasales) para el aislamiento de ADN genómico obtenido de 15 ovejas Texel. La determinación de la calidad y la cantidad de ADN se realizó mediante espectrofotometría y electroforesis en gel. Se utilizaron tasas de concordancia de genotipado para comparación. Los resultados mostraron que la concentración media más alta se obtuvo de las muestras de sangre (159,14 ng/μl), mientras que de las muestras de hisopados nasales la concentración media fue menor (130,12 ng/μl), pero la diferencia no fue significativa. En cuanto a la pureza, el ADN obtenido a partir de hisopados nasales presentó una relación A260/A280 mayor (1,96), mientras que el obtenido de muestras de sangre fue de 1,90. El rendimiento total del ADN obtenido a partir de muestras de sangre (15,91 µg) fue significativamente mayor que el obtenido a partir de hisopados nasales (6,51). Las tasas de concordancia de sangre e hisopados nasales fueron altas (media = 0,984). En conclusión, nuestros resultados indican que es posible obtener ADN de buena calidad a partir de hisopados nasales; sin embargo, se debe optimizar el protocolo de extracción de ADN.
Descargas
Referencias bibliográficas
Aguilar I. SeekParentf90 [Internet]. Georgia: University of Georgia; 2017 [cited 2024 May 03]. Available from: http://nce.ads.uga.edu/wiki/doku.php?id=readme.seekparentf90
Chacon-Cortes D, Griffiths L. Methods for extracting genomic DNA from whole blood samples: current perspectives. Journal of Biorepository Science for Applied Medicine. 2014;2:1-9.Doi: 10.2147/BSAM.S46573. DOI: https://doi.org/10.2147/BSAM.S46573
Chiong KT, Damaj MB, Padilla CS, Avila CA, Pant SR, Mandadi KK, Ramos NR, Carvalho DV, Mirkov TE. Reproducible genomic DNA preparation from diverse crop species for molecular genetic applications. Plant Methods. 2017;13:106. Doi: 10.1186/s13007-017-0255-6. DOI: https://doi.org/10.1186/s13007-017-0255-6
Fan B, Du Z, Gorbach D, Rothschild M. Development and application of high-density SNP arrays in genomic studies of domestic animals. Anim Biosci. 2010;23(7):833-47. Doi:10.5713/ajas.2010.r.03. DOI: https://doi.org/10.5713/ajas.2010.r.03
Foley C, O'Farrelly C, Meade KG. Technical note: Comparative analyses of the quality and yield of genomic DNA from invasive and noninvasive, automated and manual extraction methods. J Dairy Sci. 2011;94(6):3159-65. Doi: 10.3168/jds.2010-3987. DOI: https://doi.org/10.3168/jds.2010-3987
Hawken RJ, Cavanagh JA, Meadows JR, Khatkar MS, Husaini Y, Zenger KR, McClintock S, McClintock AE, Raadsma HW. Technical note: Whole-genome amplification of DNA extracted from cattle semen samples. J Dairy Sci. 2006;89(6):2217-21. Doi: 10.3168/jds.S0022-0302(06)72292-5. DOI: https://doi.org/10.3168/jds.S0022-0302(06)72292-5
Lee RA, Herigon JC, Benedetti A, Pollock NR, Denkinger CM. Performance of Saliva, Oropharyngeal Swabs, and Nasal Swabs for SARS-CoV-2 Molecular Detection: a Systematic Review and Meta-analysis. J Clin Microbiol. 2021;59(5):e02881-20. Doi: 10.1128/JCM.02881-20. DOI: https://doi.org/10.1128/JCM.02881-20
Li G, Gelernter J, Kranzler HR, Zhao H. M(3): an improved SNP calling algorithm for Illumina BeadArray data. Bioinformatics. 2012;28(3):358-65. Doi: 10.1093/bioinformatics/btr673. DOI: https://doi.org/10.1093/bioinformatics/btr673
Masuda Y, Legarra A, Aguilar I, Misztal I. 331 Efficient quality control methods for genomic and pedigree data used in routine genomic evaluation. J Anim Sci. 2019;97(Suppl 3):50-1. Doi: 10.1093/jas/skz258.101. DOI: https://doi.org/10.1093/jas/skz258.101
Medrano JF, Aasen E, Sharrow L. DNA extraction from nucleated red blood cells. Biotechniques. 1990;8(1):43.
Murphy MA, Shariflou MR, Moran C. High quality genomic DNA extraction from large milk samples. J Dairy Res. 2002;69(4):645-9. Doi: 10.1017/s0022029902005848. DOI: https://doi.org/10.1017/S0022029902005848
Neary MT, Neary JM, Lund GK, Garry FB, Holt TN, Mohun TJ, Breckenridge RA. Technical note: A comparison of DNA collection methods in cattle and yaks. J Anim Sci. 2014;92(9):3811-5. Doi: 10.2527/jas.2013-7445. DOI: https://doi.org/10.2527/jas.2013-7445
Núñez L, Rodríguez MI, Giménez G, Martínez R. Evaluación y comparación de dos protocolos de extracción de ADN a partir de tres tipos de muestras de ovinos. Compend Cienc Vet. 2022;11(2):18-23. Doi: 10.18004/compend.cienc.vet.2021.11.02.18. DOI: https://doi.org/10.18004/compend.cienc.vet.2021.11.02.18
Psifidi A, Dovas CI, Banos G. A comparison of six methods for genomic DNA extraction suitable for PCR-based genotyping applications using ovine milk samples. Mol Cell Probes. 2010;24(2):93-8. Doi: 10.1016/j.mcp.2009.11.001. DOI: https://doi.org/10.1016/j.mcp.2009.11.001
Psifidi A, Dovas CI, Bramis G, Lazou T, Russel CL, Arsenos G, Banos G. Comparison of eleven methods for genomic DNA extraction suitable for large-scale whole-genome genotyping and long-term DNA banking using blood samples. PLoS One. 2015;10(1):e0115960. Doi: 10.1371/journal.pone.0115960. DOI: https://doi.org/10.1371/journal.pone.0115960
R Core Team, 2021. R: A language and environment for statistical computing [WWW Document]. R Found Stat Comput. URL https://www.R-project.org (accessed 4.29.22).
República Oriental del Uruguay, Poder Legislativo.Procedimientos para la utilizacion de animales en actividades de experimentacion, docencia e investigacion cientifica. Ley N° 18.611 [Internet]. 2009 [cited 2024 May 03]. Available from: https://www.impo.com.uy/bases/leyes/18611-2009
Sambrook J, Russell DW. The condensed protocols from molecular cloning: a laboratory manual. Cold Spring Harbor: Cold Spring Harbor Laboratory Press; 2006. 800p. DOI: https://doi.org/10.1101/pdb.prot3919
Vignal A, Milan D, SanCristobal M, Eggen A. A review on SNP and other types of molecular markers and their use in animal genetics. Genet Sel Evol. 2002;34(3):275-305. Doi: 10.1186/1297-9686-34-3-275. DOI: https://doi.org/10.1051/gse:2002009
Yang W, Kang X, Yang Q, Lin Y, Fang M. Review on the development of genotyping methods for assessing farm animal diversity. J Anim Sci Biotechnol. 2013;4(1):2. Doi: 10.1186/2049-1891-4-2. DOI: https://doi.org/10.1186/2049-1891-4-2
Descargas
Publicado
Cómo citar
Número
Sección
Licencia
Derechos de autor 2024 Agrociencia Uruguay

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
| Estadísticas de artículo | |
|---|---|
| Vistas de resúmenes | |
| Vistas de PDF | |
| Descargas de PDF | |
| Vistas de HTML | |
| Otras vistas | |